
|
Molécula y enlaces |
TIPOS DE ENLACES: La molécula Una molécula es la mínima parte de materia que conserva las propiedades de un material, y puede estar formada por un sólo átomo (el helio: He, o los metales) o ser poliatómicas (como el agua: H2O). Estas últimas, a su vez, pueden estar formadas por diferentes elementos o por el mismo tipo, por ejemplo, un átomo de nitrógeno no puede existir libre en condiciones normales, por lo tanto se unen dos de ellos para formar una molécula diatómica N2. Al igual que ocurre con los átomos, se habla de peso o masa molecular, que es la suma de todas las partículas atómicas que reúnen entre todos los constituyentes de la molécula. Al igual que en el átomo, un mol es la cantidad de sustancia igual al peso molecular, y contiene 6,023 × 1023 moléculas de esa sustancia. |
Agua: H2O Masa molecular: masa de hidrógeno + masa de oxígeno= 2 × 1 + 1 × 16 = 18 En una molécula de agua hay 18 nucleones En 18 gramos de agua hay 6,023 × 1023 moléculas |
Los átomos se unen formando moléculas para compartir electrones y completar su última capa. De esta forma, se quedarán ligados entre sí por un enlace químico, y la separación entre los átomos enlazados viene fijada por el equilibrio entre las fuerzas de atracción y repulsión entre dichos átomos. Estas fuerzas son prioritariamente de atracción entre la corteza y el núcleo de los átomos diferentes, y de la repulsión entre sus núcleos y sus cortezas.
Los enlaces entre átomos para formar moléculas se denominan primarios, y pueden ser de tres tipos básicos:
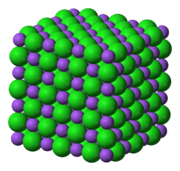
Enlace iónico
Se produce entre átomos de electronegatividad muy diferente, por lo cual un elemento muy electropositivo cede electrones a otro elemento muy electronegativo, convirtiéndose ambos en iones. La atracción electrostática entre cargas de distinto signo mantiene a los átomos formando estructuras ordenadas, homogéneas en el espacio.
 |
 |
Enlace covalente
Este tipo se produce cuando la diferencia de electronegatividad entre los elementos no es suficientemente grande como para que se efectúe transferencia de electrones, entonces los átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital denominado orbital molecular. Los enlaces covalentes se producen entre elementos no metálicos.

Las pequeñas diferencias de electronegatividad entre elementos de las moléculas covalentes provocan una tendencia de acumulación de electrones hacia el átomo más electronegativo. Si la geometría de la molécula no es simétrica debida a la posición de los orbitales, en la molécula aparece una concentración de electrones en un extremo y un defecto de electrones en el extremo opuesto.
 |
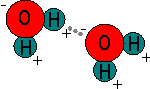 |
La existencia de esta separación de carga provoca atracciones electrostáticas entre las moléculas, lo cual explica que el agua (de masa molecular 18) sea líquida, mientras que el dióxido de carbono (de masa molecular 44) es un gas. Estas atracciones entre las moléculas se denominan enlaces secundarios o de van der Waals.
Enlace metálico
Se produce entre átomos de elementos metálicos, que tienen facilidad para ceder electrones. Los átomos adquieren un orden en el espacio y todos ceden electrones que se mueven por el material. Esta característica les confiere a los metales unas propiedades como el brillo característico (por la ordenación atómica) o la conductividad eléctrica y térmica.
 |
 |
 |
 |